摘要
目的
缺碘会增加儿童认知障碍和身体发育迟缓的风险。它还与成年人的认知障碍有关。认知能力是最容易遗传的行为特征之一。然而,对于出生后碘摄入量不足的后果以及个体遗传倾向是否会改变儿童和年轻人碘摄入量与液体智力之间的关系,人们知之甚少。
方法
文化公平智力测验用于评估DonALD研究参与者的流体智力(n = 238;平均年龄16.5 [SD = 7.7]岁)。尿碘排泄量作为碘摄入量的替代指标,在24小时尿液中测定。使用与一般认知功能相关的多基因评分评估个体遗传倾向(n = 162)。进行线性回归分析以确定尿碘排泄是否与液体智力相关,以及这种关联是否因个体遗传倾向而改变。
结果
尿碘排泄量高于特定年龄估计平均需要量与液体智力得分比低于估计平均需要量高5分相关(P = 0.02)。多基因得分与流体智力得分呈正相关(β = 2.3;p = 0.03)。多基因得分较高的参与者流体智力得分也较高。
结论
儿童期和青春期尿碘排泄量高于估计平均需水量对液体智力有益。在成人中,流体智力与一般认知功能的多基因得分呈正相关。没有证据表明个体遗传倾向改变尿碘排泄与液体智力之间的关系。
介绍
碘的充足供应对人类大脑的正常发育和正常功能至关重要[1]。碘缺乏,导致甲状腺激素分泌不足,可以在一生中观察到。妊娠期和婴儿期缺碘可损害后代的生长和神经发育,增加婴儿死亡率。在儿童和青少年中,缺碘可能会增加认知功能受损和身体发育迟缓的风险。在成人中,碘缺乏与认知障碍有关[2]。此外,在成人中,继发于甲状腺功能减退症的中度至重度碘缺乏可能引起细微但广泛的不良反应,包括教育能力下降、冷漠和工作效率降低[1]。因此,碘缺乏可能被认为是世界范围内可预防性脑损伤最重要的单一原因之一[1]。
遗传因素对人类的认知能力有重要影响。认知功能的遗传率估计在成人中为12%至25%[3,4,5],在儿童中为22%至46%[6]。如今,在成人[4]和儿童[7]的全基因组关联研究(genome-wide association studies, GWAS)中,超过140个基因座与一般认知功能相关。强有力的证据表明,基因对认知特征有很大的影响[3,4,5];然而,少数研究表明,出生后缺碘与儿童[8,9]和青少年[10]的认知表现有关,而遗传因素与碘摄入量对认知表现可能存在的相互作用尚不清楚。因此,我们在多特蒙德营养与人体测量纵向设计(DONALD)研究的参与者中调查了尿碘排泄量(UIE),作为碘摄入量的替代标记,是否与流体智力(FI)的测量相关,作为执行认知功能的测量。更具体地说,多基因评分(PGS)被用来考虑一般认知功能的个体遗传倾向。因此,我们使用PGS[11]测试了个体遗传倾向是否会改变UIE与认知表现之间的关系。
方法
研究设计
DonALD研究是一项正在进行的队列研究,收集了自1985年以来德国多特蒙德健康儿童和青少年的饮食、生长、发育和代谢信息。每年新招募35-40名3个月大的婴儿。健康的德国婴儿(即没有影响生长和/或饮食摄入疾病的婴儿),其父母愿意参加一项长期研究,并且其中至少有一人具有足够的德语知识,则有资格纳入研究。年度检查包括3天体重饮食记录、人体测量、收集24小时尿液样本(从3-4岁开始)以及生活方式访谈和医学检查。关于DonALD研究的详细信息可以在其他地方找到[12,13]。DonALD已在德国临床试验注册中心注册(DRKS-ID DRKS00029092 https://drks.de/search/de/trial/DRKS00029092)。DonALD研究的元数据可从以下存储库https://mica.mdc-berlin.de/study/donald获得。除常规检查外,在研究人群的亚群中进行附加测量(包括尿碘排泄的量化、认知功能的评估或遗传数据的生成)。
这项研究得到了波恩大学伦理委员会的批准,并根据《赫尔辛基宣言》进行。所有的检查都是在父母和孩子的书面同意下进行的。
研究人群
在2017年和2018年,附加模块“认知”被纳入了唐纳德的研究。从该模块获得数据的参与者(n = 325)被纳入本研究。如果无法获得尿液测量数据(n = 70),或早产(≤36周),低出生体重< 2500 g,或多胞胎(n = 13),则排除在分析之外,共有242名参与者。在n = 4名参与者中缺少有关协变量(出生体重、妊娠持续时间和纯母乳喂养)的信息。因此,总共有238名参与者被纳入UIE与认知功能之间关系的最终分析。717名DonALD研究参与者的遗传数据可用,其中648名在质量控制后纳入。其中,162名参与者参加了附加模块“认知”,测量了他们的UIE,他们是出生体重> 2500克的单月婴儿,没有缺失的协变量值(图1)。
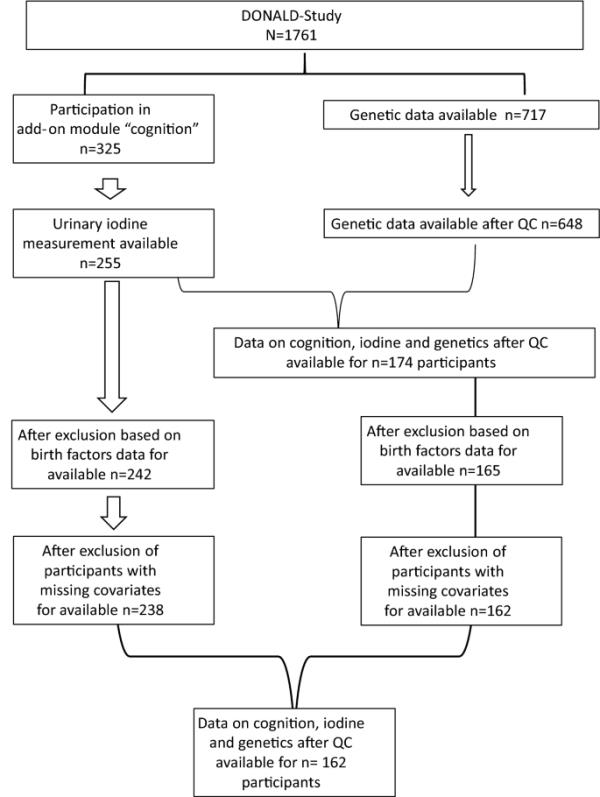
参与研究的DonALD参与者流程图
变量的评估
流体智力
在2017年和2018年,作为附加模块的一部分,使用德语版本的无语言和基于图形的文化公平智力测试(CFTs)来评估FI[14,15]。CFT 1-R用于年龄< 8.5岁的参与者,而CFT 20-R用于年龄≥8.5岁的参与者。测试采用多项选择的形式,所有的项目都是按难度排序的。FI评分是根据年龄特异性CFTs的结果计算的。
钢管在第
基于访谈的纸笔测试在三个子测试(图形任务延续、分类和矩阵)中测量FI,每个子测试包括15个任务。据报道,大约需要40分钟才能完成。所有三个子测试的正确答案被汇总成一个原始分数。这被转换成年龄标准化的FI评分。CFT 1-R具有较高的信度(r = 0.97)[14]。
钢管20-R
据报道,这一自我管理的计算机测试大约需要1小时。它由两部分(56和45题)组成,包括以下图形任务:级数的延续、分类、矩阵和拓扑结论。这两部分的正确答案被总结并转换成年龄标准化的FI分数。CFT 20-R的信度较高(r = 0.95)[15]。
尿碘排泄
在DonALD的研究中,在儿童学会使用厕所(主要是在3-4岁)之前,每年按照标准化程序进行尿液收集,这在之前的研究中已经描述过[16,17]。24小时尿液收集在其他地方有详细描述[18]。简单地说,参与者被要求在早上排空膀胱。此排尿被丢弃,时间记录为24小时尿液收集的开始时间。在接下来的24小时内,收集所有的排尿,包括第二天早上的第一次排尿。样品立即保存在不含防腐剂,外部清洗(Extran, MA03;默克公司,达姆施塔特,德国)在低于- 12°C的1升塑料容器中,然后由营养师转移到唐纳德研究中心。在该研究所,尿液样本保存在- 20°C直到分析[16]。解冻后,结合> 1个容器的尿内容物,充分混合,测定总尿量。从每个24小时的尿液样本中,20 mL的几个等份在- 22°C保存以供进一步分析,并作为DonALD尿液库的储备[19]。关于储存稳定性的信息在其他地方也有报道[19]。移液前,将样品短暂搅拌以进行特定的测量[19]。样品经酸性湿洗后,采用改进的Sandell-Kolthoff法测定尿碘(μg/L)浓度[20]。采用电感耦合等离子体质谱法(电感耦合等离子体质谱法,ICP-MS)对方法进行了验证。在50 ~ 100µg/L的最相关浓度范围内,Sandell-Kolthoff法与ICP-MS法基本一致。先前在DonALD研究中的一项调查显示,与ICP-MS相比,类内相关性为0.91[16,21]。DonALD实验室参与了EQUIP项目的验证检查[16,21]。
为了进一步减少尿液收集的潜在错误,确定了以分钟为单位的实际总收集间隔的信息。UIE由下式计算:
此外,每日肌酐排泄量< 0.1 mmol/kg体重的样本被排除在分析之外[16]。根据他们的UIE,根据碘摄入量的估计平均需求量(EAR)对参与者进行分类[22]。假设15%的非肾性碘损失,对于年龄分别小于8岁、13岁和18岁的参与者,UIE < 55、62或81 μg的参与者被归类为碘摄入量低于EAR。
对于我们的主要分析,我们在FI测量之前考虑了最新的UIE。为了进行敏感性分析,我们在FI测量前使用了多达三个尿液样本的汇总数据。在32名参与者中,只有两项测量数据可用。对于每个参与者,平均UIE是通过将个人UIE水平除以可用样本数量的总和来计算的。
基因数据和coPGS的构建
自2015年以来,唾液(年龄< 18岁的参与者)通过口腔拭子收集,血液样本通过静脉穿刺(年龄> 18岁的参与者)在附加模块“遗传”中获得。离心提取血浆,样品以500 μL的浓度保存在多特蒙德唐纳德研究中心的内部生物库中,温度为- 80℃。同样地,唾液被引用并在- 80°C冷冻。根据制造商的说明,在Life & Brain GmbH (Bonn)使用化学磁分离模块I或通过盐析(von Oragene预it净水器)从淋巴细胞和唾液中提取DNA。使用Illumina Infinium Global Screening Array v2.0进行基因分型。目前,来自唐纳德研究的717名参与者的遗传数据可用。使用Haplotype Reference Consortium面板[23,24]对总共39,131,578个遗传标记进行数据输入。在质量控制期间,剔除所有输入质量< 0.3的变异(n = 7,640,630)。此外,当偏离Hardy-Weinberg平衡时,缺失基因型信息> 0.05的单核苷酸多态性(SNPs) (n = 713,941)被剔除(P < 0.000001;N = 78)或罕见变异(次要等位基因频率< 0.05;n = 4,658,147)。这导致648名参与者共有4,658,147个遗传变异,这些变异被用于构建PGS。PGS的构建方法是首先将snp聚集在一起,以捕获连锁不平衡区域内p值最低的snp(基于Davies等人[3]的GWAS)(在遗传变异中r2 = 0.2,范围为1000 kb)。然后通过将162名参与者中每个参与者的效应大小加权相关等位基因的数量与FI的可用数据相加来计算PGS。PGS的最佳拟合P值阈值由粗FI-PGS关联的最高r2值定义(这里为0.3)。最后,对PGS进行z标准化。
协变量
尿碘测量与经CFT评估FI之间的时间以年为单位进行量化。出生特征,包括怀孕持续时间(周)和出生体重(g),从“Mutterpass”中提取,这是一份发给德国所有孕妇的标准化文件。在婴儿完全断奶前的第3、6、9、12和18个月,研究儿科医生对母乳喂养的做法和持续时间进行了评估。为了区分完全母乳喂养和部分母乳喂养,调查了是否摄入了任何额外的液体、配方奶粉或食物。完全母乳喂养持续时间(周)定义为纯母乳喂养(仅母乳喂养,不含其他食物或饮料)和主要母乳喂养(母乳与水或水基饮料混合)的周数。参与者被分为完全母乳喂养< 3周(= 0)和≥3周(= 1)的两组。定期对父母进行访谈,了解他们的社会经济特征,如母亲和父亲的教育。如果父母上学≥12年,则被归类为受过高等教育(= 1);否则,他们被归类为没有受过高等教育(= 0)。
功率计算
给定的样本量分别为238和162名受试者,考虑0.05的显著性水平和80%的幂,UIE≥EAR的受试者与UIE < EAR的受试者之间的最小可检测差异在FI评分中分别为2和2.5分。功率计算采用线性回归分析进行模拟,调整PGS(标准正态分布)和额外的8个协变量(每个4个为标准正态分布,四个为伯努利分布,每个概率为0.5)。
统计数据
研究人群的基线特征以连续变量的标准差(sd)表示,以分类变量的百分比表示。使用线性回归模型检验FI(即FI评分)与UIE(按< EAR与≥EAR分类)以及PGS之间的关联。首先,拟合单变量回归模型来研究FI与UIE和PGS的基本关联。其次,对线性回归模型进行年龄、出生因素(即出生体重、怀孕持续时间和纯母乳喂养)、测量间隔时间、CFT版本(CFT- 1r vs CFT-20- r)和父母高等教育程度的调整。包括PGS在内的分析对祖先的前五个主要成分进行了调整。然后,在UIE和PGS相互调整后,检验FI与UIE或PGS之间的相关性是否发生实质性变化。最后,测试PGS和FI之间的关联是否在调整了进一步的混杂因素(即出生因素、测量间隔时间、CFT版本和父母教育)后仍然存在。通过在回归模型中加入产品项(UIE x PGS),调整出生因素、测量间隔时间、CFT版本和父母教育程度,评估UIE和PGS之间是否存在相互作用。线性回归模型的结果由beta系数(β)、它们的置信区间(CI)和p值(p)表示。beta系数是自变量每增加一个单位时估计的结果变量的平均变化。
在敏感性分析中,使用FI测量前最多三个尿液样本的平均UIE作为习惯性碘暴露的代理,重复分析。除了UIE的分类变量外,我们还使用了UIE (zUIE)的年龄和性别标准化水平,即z得分转换,来比较UIE或PGS增加1个SD的影响。
P值为双侧,≤0.05认为有统计学意义。所有分析均使用R Software for Statistical Computing 4.1.2版本进行[25]。
目录
摘要 介绍 结果 讨论 数据和材料的可用性 参考文献 致谢 作者信息 道德声明 搜索 导航 #####结果
242名参与者的特征如表1所示。该研究的女性参与者(55%)多于男性参与者。当使用CFT-1和CFT-20R评估FI时,平均(SD)年龄分别为7.2(0.8)和19.0(7.1)岁。总体平均FI得分为110(14.0)分的CFT量表。年轻组(CFT-1)和老年组(CFT-20R)的平均UIE分别为59 (27)μg/24 h和100 (53)μg/24 h。大多数(66%)参与者的UIE高于EAR,年轻(CFT-1)和年长(CFT-20R)参与者的情况分别为41%和72%。测量UIE和给药CFT之间的中位时间为2.8年[IQR: 0.6-4.5]年;然而,年轻参与者(CFT-1)的平均寿命(0.0 [IQR: 0.0 - 0.9]年)低于年长参与者(CFT-20R)的平均寿命(3.1[1.4-5.3]年)。大多数参与者(87%)是纯母乳喂养的。平均而言,参与者接受纯母乳喂养19.0(9.4)周,大多数参与者的父亲具有较高的教育水平(73%和76%)。大多数参与者母亲的受教育程度也较高(98%和71%)。
在单变量模型中观察到UIE和FI之间的关联。具体而言,UIE≥EAR的参与者的FI比UIE < EAR的参与者高5点(95% CI 1.3-8.8;p = 0.01)。当将年龄、出生因素、测量间隔时间、CFT版本和父母教育作为协变量时,UIE≥EAR的参与者的FI平均增加4.7 (95% CI 0.9-8.5;p = 0.02)。同样,PGS与FI呈正相关。在基本模型中,高PGS的参与者比低PGS的参与者的FI几乎高3点(β = 2.7;95% ci 0.7 - 4.6;p = 0.01)。当考虑更多协变量时,多元回归模型中的关联减弱(β = 2.3;95% ci 0.3 - 4.4;p = 0.03)。然后,我们检查了当模型相互调整为UIE和PGS时,FI与UIE或FI与PGS之间的关联是否发生了实质性变化。这表明,当PGS作为协变量纳入时,UIE和FI之间的关联进一步减弱。UIE≥EAR的参与者比UIE < EAR的参与者有更高的FI评分,尽管这种关联不再显著(β = 2.4;95% CI - 1.9 - 6.8;p = 0.27)。当模型进一步针对UIE进行调整时,PGS和FI之间的关联仅略有减弱。PGS值较高的受试者的FI得分显著高于PGS值较低的受试者(β = 2.2;95% ci 0.2-4.3;P = 0.04)(图2)。没有证据表明UIE和PGS之间存在相互作用(β = - 0.7;95% CI−5.3 ~ 3.9;p = 0.76)。
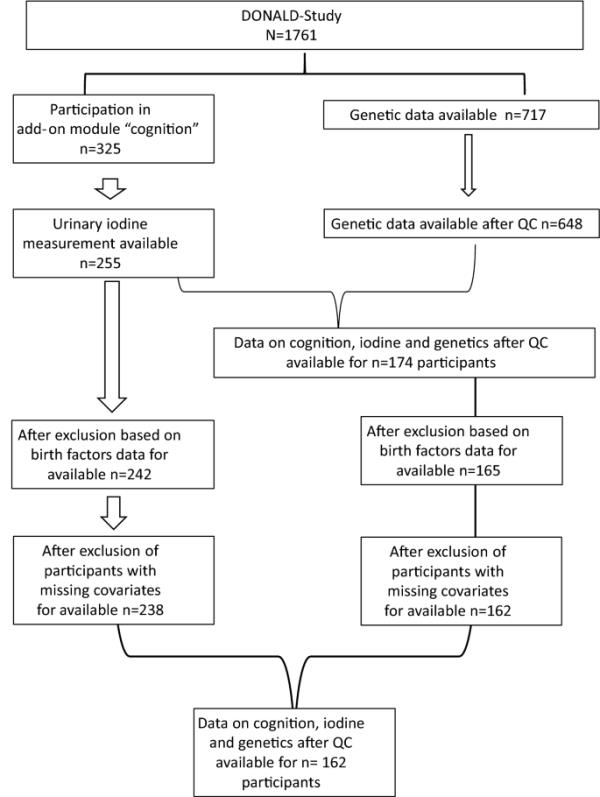
在DonALD研究中,FI评分、UIE(蓝色)和一般认知功能的PGS(橙色)之间的关联。1从粗线性回归模型获得的估计值(95%CI)。2经年龄、出生体重、妊娠期和纯母乳喂养调整后的线性回归模型获得的估计值(95%CI)、测量间隔时间、CFT版本(CFT- 1r vs CFT-20- r)和父母的高等教育程度。包括PGS在内的线性回归模型对前五个主成分进行了额外调整。4从线性回归模型(包括UIE和PGS,经年龄、出生体重、妊娠持续时间和纯母乳喂养调整)、测量间隔时间、CFT版本(CFT- 1r vs CFT-20- r)和父母高等教育程度获得的估计(95% CI)。CFT公平文化智力测验;CI置信区间;EAR估计平均需求;FI流体智能;PGS多基因评分;尿碘排泄高于耳朵
在敏感性分析中,我们纳入了最近三份尿液样本的信息,平均UIE与FI的关联与主要分析相当,但略有减弱。在单变量模型中,UIE高于EAR的参与者在FI测试中的平均得分比UIE低于EAR的参与者高4分(β = 4.1;95% CI - 1.5 ~ 9.6;p = 0.15)。多元回归模型的结果具有可比性(β = 3.7;95% CI−1.8 ~ 9.3;p = 0.19)。与主要分析一致,没有证据表明UIE和PGS之间存在相互作用(β = - 1.3;95% CI−7.8 ~ 5.2;p = 0.70)。此外,当我们使用年龄和性别标准化的UIE时,我们观察到可比较的结果(图3)。UIE和FI之间存在正相关。与具有平均UIE的参与者相比,UIE 1 SD高的参与者FI得分高2.0分(95% CI 0.1-3.9;p = 0.04)。这种关联在多变量模型中具有可比性(β = 2.3;95% ci 0.40 - 4.20;p = 0.02)。当PGS作为协变量纳入时,zUIE和FI之间的相关性进一步减弱(β = 1.40;95% CI−0.7 ~ 3.50;P = 0.18),而在这个相互调整的模型中,PGS和FI之间的关联几乎没有变化(β = 2.3;95% ci 0.2-4.3;P = 0.03)(图3)。同样,UIE和PGS之间没有发现相互作用的证据(β = 0.1;95% CI - 1.9 ~ 2.1;p = 0.93)。
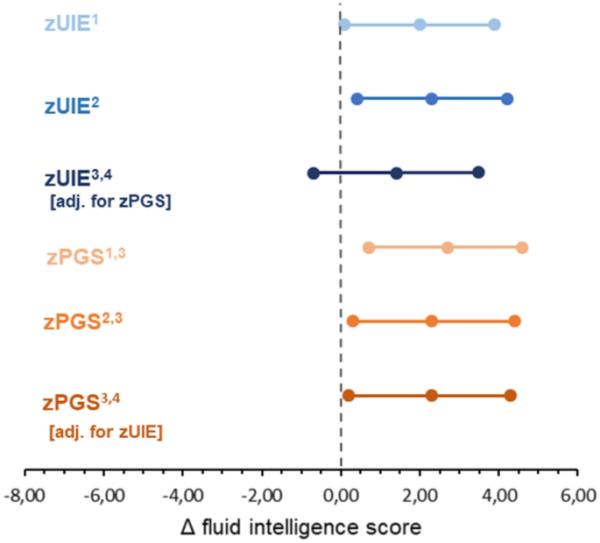
敏感性分析:DonALD研究中UIE(蓝色)或一般认知功能PGS(橙色)每增加1 SD FI评分的变化。1从粗线性回归模型获得的估计值(95% CI)。2经年龄、出生体重、妊娠期和纯母乳喂养调整后的线性回归模型估计(95% CI)、测量间隔时间、CFT版本(CFT- 1r vs CFT-20- r)和父母的高等教育程度。包括PGS在内的线性回归模型对前五个主成分进行了额外调整。4从线性回归模型(包括UIE和PGS,经年龄、出生体重、妊娠持续时间和纯母乳喂养调整)、测量间隔时间、CFT版本(CFT- 1r vs CFT-20- r)和父母高等教育程度获得的估计(95% CI)。CFT公平文化智力测验;CI置信区间;EAR估计平均需求;FI流体智能;PGS多基因评分;尿碘排泄量(z-score)
讨论
在德国DonALD研究的儿童和青少年中,我们观察到,与UIE低于参考水平的儿童相比,UIE高于EAR的儿童的FI得分高出5分。考虑到我们使用了多达三次尿碘测量,但没有整个儿童时期的习惯性碘摄入量,尿碘可能只反映了儿童和青少年时期的代用碘摄入量。此外,正如之前在成人中报道的那样,PGS也与FI评分呈正相关[4]。此外,我们使用z分数转换的年龄和性别标准化UIE调查了PGS和FI之间的关联程度是否具有可比性。该分析表明,UIE和FI之间的关联在量级上与PGS和FI之间的关联相当。为了检验这些关联的独立性,我们将UIE和PGS纳入同一模型,并观察到PGS与FI的关联大于zUIE。此外,zUIE与FI之间的关联不再显著,这表明UIE之间的关联主要由个体遗传倾向来解释。然而,我们的研究并没有表明PGS改变了UIE和FI之间的关系。
尽管对大脑发育关键阶段严重缺碘的产前影响以及轻度缺碘对智力的影响进行了广泛的研究[26],但对潜在缺碘对认知功能的产后影响知之甚少。然而,我们的研究结果显示,UIE > EAR的参与者具有更高的FI,这与之前的研究结果相当。最近一项包含19项研究的荟萃分析显示,与缺碘儿童相比,5岁以下缺碘儿童的智商低6.9-10.2分[8]。在一项包括37项研究(n = 12291)的荟萃分析中也观察到类似的结果,该分析比较了碘对生活在自然碘充足社区的儿童(年龄≤16岁)与生活在严重碘缺乏地区的儿童或在引入碘补充剂之前和之后出生的碘缺乏地区的儿童的智力发展的影响。作者观察到,严重缺碘的儿童智商低12.5分。此外,与母亲长期缺碘的儿童相比,补充碘的儿童智商比孕期补充碘的儿童高8.7分[27]。虽然上述大多数研究都调查了缺碘对大脑发育的关键阶段的影响,即在子宫和生命的最初几年,但这项研究表明,在这个时间框架之外,摄入足够的碘非常重要。因此,观察到的UIE和FI在儿童期到青年期之间的正相关,增加了现有的关于碘摄入对认知表现重要性的身体证据。
为了研究个体遗传倾向是否可能改变碘摄入量与FI之间的关系,我们根据在多达300,400名成人的GWAS研究中显示的与一般认知功能相关的遗传变异计算了PGS[4]。据我们所知,这些变异尚未被用于研究儿童FI的相关性。在这项研究中,我们在儿童和青少年中观察到与之前在成人中描述的相似的正相关[4]。值得注意的是,没有证据表明UIE和PGS之间存在相互作用。因此,在我们的主要分析中,当我们考虑最新的UIE时,没有证据表明我们的研究参与者的遗传背景影响了UIE和FI之间的关联,或者在敏感性分析中,当通过汇集最多三个UIE测量值来考虑习惯性UIE的代理时。虽然单独考虑时,UIE和个体遗传背景的关联在量级上是相当的(β: zUIE = 2.3 vs. PGS = 2.4),但敏感性分析显示,当相互比较时,个体遗传沉积似乎减弱了FI和UIE之间的关联。FI与PGS之间的相关性强于FI与zUIE之间的相关性(β: zUIE = 1.4 vs. PGS = 2.3;图3)。这可能是意料之中的,因为根据之前的GWAS,常见的遗传变异占儿童智力表型变异的22-46%[6]。有趣的是,基因对一般认知能力的影响随着年龄的增长而增加。在来自四个国家(即英国、美国、荷兰和奥地利)的11,000对双胞胎样本中,一般认知能力的遗传率估计显著增加,并呈线性增长,从童年(9岁)的41%增加到青春期(12岁)的55%,再到青年期(17岁)的66%[28]。在DonALD研究的样本中,年轻参与者(平均年龄7.2±0.84岁)和年长参与者(平均年龄19±7.1岁)之间的FI评分没有差异。然而,我们根据年龄调整了我们的分析,因为随着生活过程中经验的积累,环境影响越来越多地解释了个体行为差异[28]。
大约85%的碘是通过尿液排出的,这使得UIE非常适合作为碘摄入量的替代指标。因此,建议监测人群中的碘状况[29]。有趣的是,在DonALD研究中,牛奶、鱼、蛋和肉的摄入量被报道可以预测UIE[30]。同样,在英国东南部的孕妇中,摄入牛奶、鸡蛋和海鲜,而不是肉类和家禽,被发现与估计的24小时UIE呈正相关[31]。然而,我们尚未调查这些食物组是否与FI有关。先前一项包括866名平均年龄为72岁的苏格兰参与者的研究发现,在3年的随访中,摄入低碘食物(即乳制品和鱼类)的参与者脑容量萎缩增加[32]。同样,在≥65岁的参与者中,食用鱼类与认知能力下降较慢有关[33],而在70-74岁的参与者中,食用鱼类与认知能力下降较慢有关[34]。此外,包括地中海饮食[35]和MIND饮食[36]在内的饮食模式对阿尔茨海默氏痴呆症的发展有益。然而,对于儿童和青少年的饮食模式和认知能力之间的关系,人们知之甚少。最近的一项荟萃分析包括21项研究,调查了6-18岁儿童或青少年的执行功能,得出的结论是,健康的饮食模式(即富含水果、蔬菜、全谷物和鱼类)与执行功能呈正相关,而不健康的零食、含糖饮料和红/加工肉类与执行功能呈负相关[37]。尽管如此,人们通常认为,摄入鱼类与认知能力之间的有益联系是由于油性鱼类中含有大量的长链n-3 PUFAs[38],而不是因为鱼类富含碘。然而,补充碘有益于缺碘学童的认知功能[9,10]。在DonALD研究中3 -≤6岁的儿童中,摄入牛奶(42%)和盐(42%)对通过肾脏排出的碘量贡献最大,而摄入肉类(7%)、鸡蛋(7%)和咸水鱼(2%)的贡献较小[18]。此外,DonALD的研究表明,在8.5-32岁的参与者中,生活方式评分(包括儿童和青少年时期的饮食、身体活动、久坐行为和睡眠时间)与随后测量的FI评分呈正相关[39]。饮食成分包括摄入水果,蔬菜,全谷物,含糖饮料,鱼,红肉和香肠,但尚未单独调查与FI的关系。因此,未来研究是否饮食模式解释碘摄入量的变化可能会影响认知表现,特别是在年轻人中,将是有趣的,至少因为根据2005年至2006年进行的德国国家调查[40],碘摄入量在青少年和年轻人中最低,最近的数据表明,德国儿童的碘状况有所下降[16,41]。
优势与局限
本研究有一定的局限性。认知功能是一种多因子表型;因此,多变量回归模型包括各种混杂因素,但有些在DonALD研究中不可能被考虑。首先,低出生体重(< 2500 g)与儿童[42]、青少年[43]和成人[44]的认知功能低下有关。然而,在正常出生体重范围内(> 2500 g),出生体重与认知能力呈正相关[45]。此外,更长的妊娠期被发现与有益的认知发展有关,即使在足月婴儿中也是如此[46]。因此,我们调整了出生体重和怀孕时间的分析。其次,母体碘补充被发现与认知功能有关[26]。很少有研究参与者(n = 2)可以获得母体碘补充的信息。第三,在敏感性分析中,多达三种尿碘测量值被合并,以检查随时间习惯性碘暴露的代理。为了获得可靠的估计,需要10至24小时尿液样本的习惯性摄入数据[47]。第四,DonALD研究中通过CFT-1和CFT-20R评估FI的方法尚未得到验证。然而,与PGS的正相关是基于先前与一般认知功能相关的遗传变异[4],这表明CFTs可以作为区分认知功能较低和较高参与者的一种措施。第五,PGS的构建可能不被认为是完全独立的,因为在已知的遗传变异中[4],只有那些基于DonALD研究中FI与PGS之间的粗略关联,p值阈值< 0.3的snp才被纳入PGS。然而,在最近的GWAS中,PGS中包含的遗传变异的一般选择是基于先前确定的与一般认知功能相关的遗传变异(在连锁不平衡区(r2 = 0.2,范围1000 kb)内)[4]。第六,DonALD研究的主要研究目的是调查膳食摄入量、生活方式和人体测量学;因此,加入研究计划的附加模块的样本量是有限的。然而,我们的幂次分析显示,238名和162名参与者的样本量分别足以观察到FI得分的两个点的差异,考虑到α水平阈值为0.05,幂次为80%。尽管如此,样本量太小,无法观察到80%功率下合理效应大小的相互作用。最后,DonALD的研究在社会经济地位方面不一定代表一般人群[12]。
总之,我们的研究证实,碘摄入量和遗传易感性都与儿童、青少年和早期成人的认知功能有关。没有证据表明碘摄入量与认知功能的遗传易感性之间存在相互作用。进一步的研究,特别是更明确地评估认知能力的研究,即除了FI之外,还包括进一步的认知领域,是有必要的。此外,为了了解中度至重度碘缺乏症可能继发于甲状腺功能减退症的人群中细微但广泛的不良影响(包括受教育程度下降、冷漠和工作效率降低),需要对青年至中年参与者进行长期随访调查。最后,研究富含碘的不同食物组或解释个体碘摄入量变化的饮食模式是否与认知表现有关,将是一件有趣的事情。
下载原文档:https://link.springer.com/content/pdf/10.1007/s00394-023-03152-6.pdf







