摘要
背景
晚期结直肠癌(CRC)很难治疗。因此,开发新的治疗方法是必要的。在这里,我们描述了一个潜在的可操作的质膜靶标,氨基酸转运蛋白亚基CD98hc。
方法
对结直肠癌患者配对的正常组织和肿瘤组织进行CD98hc蛋白的Western blot和免疫组化分析。利用免疫荧光和western研究来表征基于dm1的cd98hc定向抗体-药物偶联物(ADC)的作用。通过MTT和Annexin V研究来评价抗cd98hc - adc对细胞增殖和凋亡的影响。使用CRISPR/Cas9和shRNA来探索ADC的特异性。体外分析了抗cd98hc - adc对3D患者来源的正常器官和肿瘤类器官的抗肿瘤活性。使用异种移植的CRC细胞和PDX来分析抗cd98hc - adc的抗肿瘤特性。
结果
配对正常和肿瘤样本的基因组学和蛋白质组学分析表明,与正常结肠组织中的CD98hc水平相比,肿瘤组织中的CD98hc表达明显更高。在人结直肠癌细胞系中,一种识别CD98hc外结构域的ADC到达溶酶体并发挥有效的抗肿瘤活性。通过shRNA减少CD98hc或CRISPR/Cas9删除CD98hc的CRC细胞,证明了CD98hc导向ADC的特异性。对患者来源的类器官的研究证实了抗cd98hc - adc的抗肿瘤作用,它在很大程度上保留了正常组织来源的结肠类器官。使用异种移植的结直肠癌细胞或患者来源的异种移植的体内研究证实了抗cd98hc - adc的抗肿瘤活性。
结论
本文报道的研究表明,CD98hc可能是一种新的ADC靶点,经过精心设计的临床试验,可用于增加针对CRC的治疗手段。
背景
结直肠癌(Colorectal cancer, CRC)是诊断频率第三高的癌症,占所有癌症死亡人数的9.4%[1]。虽然治疗进展有所改善,但其在转移情况下的预后很差[2]。因此,应制定更有效的治疗策略,以提高该疾病患者的总体生存率和生活质量。
针对细胞表面蛋白的单克隆抗体在包括CRC在内的多种肿瘤疾病中显示出临床益处[3]。这些抗体的一个复杂版本是抗体-药物偶联物(adc)。adc由三部分组成:针对细胞表面蛋白的抗体、细胞毒性药物和用于将细胞毒性药物附着在抗体上的化学连接物[4]。虽然有几种adc已经进入肿瘤临床,但没有一种adc被批准用于CRC[5]。然而,由于它们在治疗其他肿瘤类型方面的成功,一些正在进行的研究正在分析靶向不同细胞表面蛋白的adc在结直肠癌中的治疗价值。从这个意义上说,针对CEACAM5 (labetuzumab-govitecan)[6,7]、HER3 (patritumab-deruxtecan)[8,9]或HER2(曲妥珠单抗-deruxtecan和曲妥珠单抗-emtansine)[10]的adc目前正在CRC中进行测试。
为了增加不同肿瘤的治疗选择,并考虑到ADC在临床中的成功,一些研究描述了不同的策略来确定新的ADC靶点[11,12,13,14,15]。与非肿瘤组织相比,这些策略是基于对肿瘤组织中优先存在的细胞表面蛋白的分析。该方法最近被用于三阴性乳腺癌,以详细列出肿瘤组织中差异表达的细胞表面蛋白目录[14],最终目的是评估其中一些蛋白是否可用于治疗目的。其中一种鉴定的蛋白是CD98hc,这是一种细胞表面糖蛋白,通过与LAT1异源二聚化参与必需氨基酸的摄取[16,17]。多项研究表明,CD98hc在不同肿瘤中高表达,并被认为在肿瘤进展[14,16,18,19,20,21,22,23,24,25,26,27,28,29,30]和转移传播中发挥作用[31]。此外,在果蝇中获得的遗传证据表明,CD98hc表达增强有利于肿瘤进展,可能是因为与CD98hc相关的几种轻链转运蛋白同时上调[32]。
在结直肠癌中,最近的一项研究评估了CD98hc在转录和蛋白水平上的表达,结果表明,相对于正常结肠黏膜和大多数良性结直肠癌病变,CD98hc在癌中升高[33]。本研究还表明,LAT1-CD98hc复合物蛋白的表达在结直肠癌患者中没有显著的预后价值。然而,这一结论与另一篇报道的结果相反,该报道发现CD98hc水平与CRC预后较差呈正相关[34]。
上述评论以及其他研究[35]表明CD98hc可能是CRC的潜在治疗靶点。考虑到结直肠癌需要新的治疗方法,以及抗CD98hc ADC在三阴性乳腺癌中的成功抗肿瘤活性[14],我们决定探索CD98hc是否可以作为结直肠癌的可行靶点。使用来自结直肠癌患者的配对肿瘤和非肿瘤样本,我们在这里显示CD98hc在正常组织和肿瘤组织中表达差异。此外,体外研究表明,CD98hc-ADC在结直肠癌细胞系中内化并发挥强大的抗肿瘤作用。此外,使用患者来源的正常和肿瘤CRC类器官的实验,以及在小鼠和pdx中使用异种移植细胞系的研究表明,抗cd98hc ADC具有体内和体外抗肿瘤活性。
方法
试剂和抗体
Dulbecco改良Eagle培养基(DMEM)、胎牛血清(FBS)、青霉素、两性霉素B和链霉素购自Life Technologies (Carlsbad, CA, USA)。6-二氨基-2-苯基吲哚(DAPI)和3-(4,5 -二甲基噻唑-2-基)- 2,5 -二苯基溴化四唑(MTT)来自Sigma-Aldrich (St Louis, MO, USA)。Immobilon®-P传递膜来自Merck Millipore Corp. (Darmstadt, Germany)。安全易溶毒素(SET™)来自Levena Biopharma (San Diego, CA, USA)。Annexin V-FITC来自BD转导实验室(San Jose, CA USA)。其他非专利化学品来自Sigma-Aldrich、USB Corporation (Cleveland, OH, USA)、Roche Biochemicals (Hoffmann, Germany)或Merck (Darmstadt, Germany)。
抗ERK1/2(克隆# C-9,参考文献sc-514302, WB: 1:50 000)、calnexin(克隆# E-10,参考文献sc-46669, WB: 1:10 000)、cyclin B1(克隆# GNS1,参考文献sc-245, WB: 1:50 000)、CD98hc(克隆# 4F2,参考文献sc-59145,用于免疫荧光、细胞表面染色和制备ADC,本文命名为抗cd98hcecto或抗CD98hc)和GAPDH(克隆# H-12,参考文献sc-166574, WB: 1:10 000)的抗体来自Santa Cruz Biotechnology (Santa Cruz, CA, USA)。抗CD98hc抗体(克隆# D3F9D,参考文献#47213用于Western blot: 1:8 000和免疫组织化学实验:1:500,称为抗cd98hcv509), LAMP1(克隆# D2D11,参考文献#9091,IF: 1:20 00), phospho-HA2X (S139)(参考文献#2577,WB: 1:3 000), phospho-Rb (S780)(克隆# C84F6,参考文献#3590,WB: 1:5 000), phospho-cdc2 (CDK1) (Y15)(参考文献#9111,WB: 1:8 000), PARP(参考文献#9542,WB: 1:6 000)和cleaved caspase 3(克隆# 5A1E,参考文献#9664,WB:1:10 00)来自Cell Signaling Technologies (Beverly, MA, USA)。抗细胞周期蛋白A(克隆# 25/ cyclin A,参考文献#611268,WB: 1:50 000), BUBR1(克隆# 9/BUBR1,参考文献612503,WB: 1:35 500)和核孔蛋白(参考文献N43620-150, IF: 1:20 00)的抗体来自BD转导实验室。抗CA2抗体(参考文献CSB-PA004370GA01HU, WB: 1:10 00),用于Western blot,来自Cusabio (Houston, TX, USA)。抗α -微管蛋白(克隆# DM1A,参考文献CP06, WB: 1:10 000)和抗磷酸- h3 (S10)(参考文献# 06-570,WB: 1:50 000)来自默克密理博公司(德国达姆施塔特)。抗β-微管蛋白(克隆# TUB 2.1,参考文献T4026, IF: 1:20 00)来自Sigma-Aldrich。已经报道了针对牛血清白蛋白(BSA,来自Sigma-Aldrich)偶联DM1 (MedChemExpress, Sollentuna, Sweden)制备的抗DM1抗体以及抗cd98hc与DM1的偶联[14]。识别小鼠IgG和兔IgG的酶标二级抗体分别来自GE Healthcare Life Sciences (Piscataway, NJ, USA)(参考文献NA931,稀释倍数1:10 000)和Bio-Rad Laboratories (Hercules, CA, USA)(参考文献#1706515,稀释倍数1:20 000)。
细胞培养,细胞增殖和细胞周期测定
细胞生长在Dulbecco改良Eagle培养基(DMEM) (Caco-2、HCT116、HT29、SW480、SW620和HaCaT)或F-12K培养基(Kaighn 's Modification of Ham 's F-12 medium) (LoVo)或Leibovitz 's L-15培养基(SW48)中,添加10%胎牛血清(FBS),含高糖(4500 mg/ ml)和抗生素(青霉素100 U/ml,链霉素100µg/ml)。细胞系在37°C、5% CO2和95%空气存在的潮湿气氛中培养。细胞真实性在萨拉曼卡大学医院血液科进行了分析。人类成纤维细胞是从接受手术的患者的正常组织中获得的。这些细胞在DMEM + 10%胎牛血清中培养。
如前所述,通过MTT代谢和碘化丙啶染色评估细胞增殖[36]。
慢病毒的产生和感染
对于慢病毒生产[14],4µg以下质粒:pMDLg/RRE, prv - rev和pMD2。G (Addgene, Cambridge, MA, USA),连同8µG的pLKO。用JetPEI®试剂(poly+ -transfection, Illkirch, France)将1个含有scramble shRNA (sh-Control)或CD98hc shRNA (GE Dharmacon, Lafayette, CO, USA)的慢病毒质粒共转染HEK293T细胞[37]。24小时后,将HEK293T培养基替换为新鲜培养基,共转染48 h后,收集含有慢病毒颗粒的培养基,过滤后,加入6µg/ml聚布烯(Sigma-Aldrich),用于感染HT29和HCT116细胞。细胞培养48小时,随后用3µg/ml嘌呤霉素(Sigma-Aldrich)选择48小时。检测靶向CD98hc的5种不同shRNA序列(#3 GCCTGGACTCTTCTCCTATAT;# 4 CGAGAAGAATGGTCTGGTGAA;# 5 TCCGTGTCATTCTGGACCTTA;# 6 GCTGGGTCCAATTCACAAGAA;使用了#7 CTAGCTCATACCTGTCTGATT)和产生较高水平敲除的基因(#3和#7)。
免疫沉淀和免疫印迹
已经描述了用于蛋白质分析、免疫沉淀和Western blotting程序的细胞提取物的制备[38,39]。从结直肠癌患者的配对样本(正常组织和肿瘤组织)中提取细胞提取物的制备方法在异种移植研究中如下所述。根据要分析的蛋白质的分子量,钙连联蛋白、微管蛋白或GAPDH被用作加载对照。CA2作为结肠正常组织对照[40,41]。使用Image Lab™软件版本6.0.1 Bio-Rad Laboratories (Hercules, CA, USA)进行条带密度测量,该软件配备ChemiDoc仪器。将50µl 2,2,2-三氯乙醇加入10 ml SDS-PAGE凝胶溶液中进行无染色。根据制造商的说明,在ChemiDoc仪器(Bio-Rad)中检测总蛋白。
免疫荧光显微镜
已有细胞系免疫荧光方案的报道[42]。简而言之,细胞在玻璃罩上培养,插入35 mm的培养皿中,用10 nM的抗cd98hc或抗cd98hc - dm1处理。盖片上的细胞用PBS/CM (1mm CaCl2, 0.5 mM MgCl2 in PBS)洗涤,用2%多聚甲醛固定,然后用PBS/CM洗涤。孵育用50 mM NH4Cl淬火。细胞被渗透(0.1% triton, 0.2% BSA),然后与细胞在含有0.2% BSA的PBS/CM阻断液中孵育1小时。将抗lamp1抗体(克隆号D2D11,参考号9091,稀释度1:200)、抗β-微管蛋白抗体(克隆号TUB 2.1,参考号T4026,稀释度1:200 00 0)或抗核孔蛋白抗体(参考号N43620-150,稀释度1:200 00 0)加入到封闭液盖上的细胞中,室温下放置2小时。在0.2% BSA的PBS中洗涤三次,每次10分钟,与cy3偶联的抗小鼠(稀释1:500),cy2偶联的山羊抗兔(稀释1:100)或cy2偶联的抗小鼠(稀释1:100)抗体在阻断液中孵育30分钟。在0.2% BSA的PBS中洗涤三次,10分钟,细胞核用DAPI染色,然后装上。采用Leica TCS SP5系统(Leica Microsystems CMS, Wetzlar, Germany)的共聚焦免疫荧光显微镜对样品进行分析。
用于人体类器官(20-40µm)的免疫荧光实验,将其接种于12孔板(1200个类器官/孔)。两天后,分别与抗cd98hc抗体单独孵育或与DM1结合孵育,孵育时间如图图例所示。处理后,除去培养基,用PBS洗涤类器官。室温下用3.7%多聚甲醛固定60 min。然后用刮刀将类器官从板上分离出来,收集在1.5 mL的锥形管中,用PBS洗涤,用1% PBS- bsa稀释的0.1%甘氨酸在室温下孵育30分钟。然后将类器官涂在显微镜载玻片上,用0.5% Triton-X-100在PBS中渗透15分钟,0.01% Tween-20在PBS中渗透5分钟。在0.01% Tween-20的PBS中洗涤三次后,类器官用山羊抗小鼠- alexa 488抗体(1:400)(Thermo Fisher Scientific, MA, USA)在RT下孵育1小时,细胞核用DAPI染色。使用配备LAS AF软件(版本2.6.0.7266,徕卡)的DM2000徕卡显微镜拍摄图像。
流式细胞仪分析
已有文献报道HT29细胞和BT6224肿瘤中CD98hc细胞表面染色的方法[14]。简单地说,将肿瘤BT6224切碎,用1型胶原酶(Worthington) 1 mg/ml在Hanks平衡盐溶液(HBSS)中搅拌2小时,37°C。随后,分离的细胞用40µm细胞滤器过滤,并用HBBS洗涤2次。然后,细胞在DMEM + 10%胎牛血清中培养2天。细胞用抗cd98hc - dm1 (10 nM, 37℃,20 min)处理,胰蛋白酶化,收集于培养基中,1200转/分离心5 min,重悬于PBS + 2% BSA中。随后,细胞用抗小鼠FITC (1:100, Cytognos S.L, Salamanca, Spain)室温搅拌30分钟。随后,用PBS + 2% BSA洗涤细胞2次,使用Accuri C6流式细胞仪(BD转导实验室)用流式细胞仪分析CD98hc的表达。
CD98hc的类器官细胞表面染色:培养4天后,用1 mg/mL (Thermo Fisher Scientific)培养液从基质中提取30分钟。类器官用TripLEx(在PBS中稀释1:4)孵育10分钟,通过21G注射器传递10次。接下来,计数细胞,用anti-CD98hc-DM1孵育(10 nM, 30 min)。随后,用PBS + 0.1% BSA + EDTA 5 mM(洗涤缓冲液)洗涤细胞两次,并用anti-Mouse Alexa 488 (1:400, Thermo Fisher Scientific, MA, USA)孵育16分钟。两次细胞洗涤后,用FACS (Cytoflex S细胞仪,Beckman Coulter, Barcelona, Spain)使用Flow Jo(10.40.1)软件分析CD98hc的表达。
人类的样本
接受手术的结CRC患者的新鲜人体组织由La Paz大学医院- idipaz(西班牙马德里)生物库或PMC-BEOCyL(西班牙萨拉曼卡Castilla y肿瘤疾病比较分子病理学-生物库网络León),西班牙生物库网络参与中心(www.redbiobancos.es)提供。该研究符合所有伦理规定,并得到了拉巴斯大学医院伦理委员会(hlp - pi -1425和hlp - pi -3169)和萨拉曼卡大学医院伦理委员会(西班牙萨拉曼卡)的批准。根据《赫尔辛基宣言》,所有患者在进入研究前都给予了知情同意。
建立三维正常和肿瘤类器官培养
为了建立来自结直肠癌患者的人类结肠正常和肿瘤类器官培养物,按照前面的描述对正常粘膜和肿瘤活检组织进行处理[40]。首先将活检组织与抗生素(普莫菌素、庆大霉素、真菌素)的混合物在室温下孵育1小时。
为了产生正常的类器官培养物,样品与10 mM二硫苏糖醇(DTT)在室温下孵育10分钟,然后与8 mM EDTA溶液在4℃慢速旋转下孵育60分钟。然后通过摇动从粘膜中分离出隐窝,并包埋在Matrigel (Corning, MA, USA)中,将其滴入预热的培养皿中。在Matrigel凝固后,加入完整的“Normal”培养基:Wnt3a-conditioned中先进的DMEM / F12 50%, 50%, 10毫米玫瑰,Glutamax 10毫米,10毫米烟酰胺(Sigma-Aldrich), 1×N2, 1×B27(美国马热费希尔科学),1毫米N-acetyl-L-cysteine (Sigma-Aldrich), 1:50 0 Primocin 0.1μg / mL的大脑(Peprotech,新泽西,新泽西,美国),1μg / mL胃泌激素(Tocris,英国布里斯托尔),1μg / mL RSPO1 (Sinobiological,北京),50 ng / mL EGF (Peprotech), 0.02μM PGE2 (Sigma-Aldrich), 1μM ly - 2157299(荷兰格罗宁根Axon-Medchem,),10 μM SB-202190 (Sigma-Aldrich)。
人肿瘤类器官培养方法如下:将肿瘤活检切片切成小块,在含有1 mg/mLⅳ型胶原酶(Sigma-Aldrich)的PBS液中酶解,37℃下,在水浴中连续摇晃30分钟。为了获得单细胞,我们将悬浮液通过18G注射器强制细胞分解,并将溶液通过100 μm滤网收集单细胞。最后,将包埋于Matrigel中的细胞接种于预热的培养皿中直至凝固,加入“Tumor”培养基(“Normal”培养基减去wnt3a条件培养基、烟酰胺和RSPO1)。
为了传代,用1mg/mL (Thermo Fisher Scientific)溶液孵育30分钟后,从类器官中去除Matrigel。类器官用TripLEx(在PBS中稀释1:4)孵育5分钟,通过21G注射器。在洗涤缓冲液(Advanced DMEM/F12, 10 mM HEPES, 10 mM Glutamax)中洗涤颗粒状类器官后,将破坏的类器官包埋在Matrigel中,并在预热的培养皿上播种。
药物在肿瘤类器官中的活性按照先前发表的方案进行[43]。类器官用10 nM抗cd98hc - dm1或载体处理4天,使用细胞滴度- glo 3D细胞活力测定试剂盒(Promega, Madison, WI, USA)测定细胞活力。
异种移植研究
老鼠是在研究所的动物设施处理的,所有的治疗都是按照法律和机构的指导方针进行的。雌性BALB/c裸鼠,7周龄,来自Charles River Laboratories (Wilmington, MA, USA)。将DMEM + 10%胎牛血清50µl和Matrigel (Corning) 50µl的HT29细胞共5 × 106个皮下注射到小鼠右侧。当肿瘤达到150 mm3时,将动物随机分为两组(每种情况n = 4-6只),治疗开始时每周腹腔注射抗cd98hc -DM1或抗cd98hc -DM1(共3次剂量)15 mg/kg,或DM1 (0.14 mg/kg,每周一次,共3次剂量)。用数字卡尺(Proinsa, victoria, Spain)连续测量肿瘤直径,每3-4天(每周2次),肿瘤体积计算公式如下:V = (L × W2)/2,其中V =体积(立方毫米),L =长度(毫米),W =宽度(毫米)。在治疗开始后的第21天,通过吸入二氧化碳牺牲动物,获得肿瘤样本,并立即将其中一块冷冻在液氮中。在液氮中冷冻的肿瘤切碎,用PBS洗涤,并在冰冷的裂解缓冲液(2 ml/100 mg肿瘤)中均质(Dispomix, L&M Biotech, Holly Springs, NC, USA)。匀浆在4℃下10000 × g离心20 min,将上清转移到新管中。
结直肠癌患者衍生异种移植(PDX)研究
生物伦理程序由萨拉曼卡大学医院伦理委员会(患者来源材料)和萨拉曼卡大学伦理委员会(动物操作)批准。收集结直肠癌患者术后新切除的肿瘤。将肿瘤置于添加抗生素(青霉素、链霉素)、抗真菌(两性霉素B)和10%胎牛血清的DMEM培养基中,静置1 ~ 3 h后,将肿瘤组织切成3 × 3x3 mm的片状,皮下置于7周龄雌性BALB/c裸鼠背部左侧。当肿瘤达到600-1200 mm3 (P1:第一代异种移植物)时,将肿瘤扩展到另一只小鼠(P2)。同样,当肿瘤达到600 - 1200mm3时,处死小鼠,然后再次将肿瘤扩大至8只小鼠。当肿瘤达到230 mm3时,将小鼠分为两组(n = 4,分别为对照组和治疗组),治疗组(第10天腹腔注射)抗cd98hc - dm1 15 mg/kg(共3次剂量)。用数字卡尺(Proinsa, victoria, Spain)连续测量肿瘤直径,每3-4天(每周2次),肿瘤体积计算公式如下:V = (L × W2)/2,其中V =体积(立方毫米),L =长度(毫米),W =宽度(毫米)。吸入二氧化碳杀死动物后,于治疗开始后第28天获得肿瘤样本,并立即将其中一块冷冻在液氮中。从肿瘤中提取蛋白质的方法与异种移植研究一样。
CD98hc的组织阵列和免疫组化分析
结肠癌组织标本用福尔马林固定,石蜡包埋。用切片机(Leica Microsystems GmbH, Wetzlar, Germany)切割3微米的切片,并转移到涂有粘合剂的载玻片上。按照制造商的说明,使用Leica BOND-III全自动免疫组化和ISH染色系统(Leica Microsistemas S.L.U. All Microscopy and Histology, Barcelona, Spain)对这些切片进行免疫组化。使用抗CD98hc (Cell Signaling Technology,克隆# D3F9D,参考编号#47,213)在1:500稀释20分钟,分析CD98hc的表达。
组织微阵列(TMA)用于免疫组化分析26例原发肿瘤、34例肝转移瘤和16例淋巴结转移瘤的CD98hc水平[44]。TMA CD98hc评分计算如下:i)肿瘤细胞染色百分比:0- 0;1- < 10%;2 - 10 - 50%;3 - 50 - 75%;4- > 75%。ii)强度:0负;(1) +弱;(2) + +适度;(3) + + +激烈。
CRISPR/Cas9缺失CD98hc
HT29细胞(35 mm板,50-80%汇合)转染1.5µg的3个质粒混合物,这些质粒分别靶向3个不同序列的CD98hc (CD98 CRISPR/Cas9 KO, ref. SC-400501),每个质粒编码Cas9核酸酶和一个用于CD98基因敲除效率最高的靶向特异性20 nt引导RNA (gRNA),以及1.5µg由2-3个质粒组成的CD98 HDR质粒。每个都含有一个同源定向DNA修复(HDR)模板,该模板与CD98 CRISPR/Cas9 KO质粒产生的切割位点相对应,并且允许使用JetPEI DNA转染试剂选择含有CD98 CRISPR/Cas9 KO质粒诱导的DSB的细胞(Santa Cruz Biotechnology, sc-400501)。3天后,用3µg/ml的嘌呤霉素孵育2周(每3天或4天换一次培养基)。在不使用嘌呤霉素的情况下,将细胞再维持4周,当克隆可见时,将其分离。单个克隆在24孔板中生长,随后扩大。western blot分析不同克隆CD98hc的表达情况。
统计分析和计算机研究
采用SPSS 15.0 (SPSS Inc.)软件进行统计分析。芝加哥,伊利诺伊州,美国)。除非另有说明,否则采用双侧学生t检验对两组体外测定的连续变量进行比较。p < 0.05为差异有统计学意义。所有实验至少重复两次。给出了研究结果的代表性结果。
使用TNMplot和GENT2在线数据库对人类样本中CD98hc的表达进行了计算机评估。在这些数据库中会自动给出表达式单位。从TNMplot数据库中获得的数据中,正常样本和肿瘤样本之间的统计学显著差异用红色标记。
目录
摘要 背景 方法 结果 讨论 结论 数据和材料的可用性 缩写 参考文献 致谢 作者信息 道德声明 补充信息 搜索 导航 #####结果
前女友CD98hc在co中的表达朗癌症
术后对来自27例患者的配对正常和肿瘤组织样本进行CD98hc表达评估。Western blot分析显示,一种抗体可以识别位于CD98hc细胞外区域Val509周围的表位(抗cd98hcv509),在正常和肿瘤CRC组织样本中都表达CD98hc(图1A)。在分析的所有27例病例中,肿瘤样本中CD98hc的表达明显(p < 0.0001)高于正常结肠样本(图1A、B和C)。这些数据与使用TNMplot在线工具[45]获得的41对配对样本的数据一致(获取于2022年12月,补充图1A)。另外,使用Gepia2在线工具进行的计算机研究,可以比较正常组织和肿瘤组织之间的表达[46],显示CD98hc(基因名称SLC3A2)在肿瘤组织中的表达显著高于正常结肠组织(p = 0.01)(补充图1B)。使用TNMplot也发现了非配对正常组织和肿瘤CRC之间CD98hc表达的差异(补充图1C)。对在线数据的分析表明,与正常组织相比,CD98hc在肿瘤组织中的表达经常上调(补充图1G和H)。
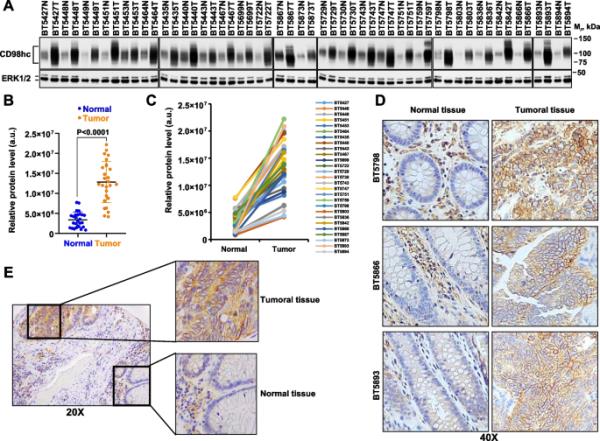
CD98hc在结直肠癌患者正常组织和肿瘤组织中的表达。CD98hc在结直肠癌患者配对样本(正常和肿瘤结肠组织)中的表达。Western检测CD98hc,采用抗cd98hcv509抗体。ERK1/2作为加载对照。N =正常组织,T =肿瘤组织。分子量标记的位置如图所示。B和C表示a所示数据中任意单位CD98hc的相对蛋白水平。B中的P值采用Mann Whitney U检验计算。CD98hc的定量方法见方法部分。D用抗cd98hcv509抗体对配对结肠样本(正常和肿瘤组织)进行CD98hc免疫组化染色。放大:40 x。E患者标本中CD98hc的免疫组织化学染色,包括肿瘤组织和正常组织。放大倍率:20倍
使用抗cd98hcv509抗体进行免疫组化研究表明,配对样本的肿瘤组织中CD98hc的染色明显高于正常组织中的染色(图1D)。肿瘤组织的CD98hc染色模式为典型的细胞表面蛋白(膜性染色)。在正常配对样本中,CD98hc染色主要局限于肠黏膜固有层炎症间质成分。在包括正常组织和肿瘤组织的样本中,正常结肠中CD98hc的染色明显低于邻近肿瘤区域的染色(图1E)。转移组织(淋巴结或肝转移)保留CD98hc的表达(补充图1D-F)。
抗体介导的CD98hc在co中的内化Lon癌细胞
为了探索靶向CD98hc在结直肠癌中的潜在抗肿瘤作用,我们采用了一种先前在三阴性乳腺癌中被证明是成功的策略[14]。该策略基于ADC的构建,使用识别CD98外结构域的抗体(抗cd98hcecto),与强效抗微生物小管剂DM1偶联。值得注意的是,用于免疫印迹和免疫组织化学研究的抗体,抗cd98hcv509抗体,不能用于此目的,因为它不能识别天然CD98hc。
初步实验旨在验证抗cd98hcecto抗体是否与天然细胞表面CD98hc相互作用并内化到结肠癌细胞内。抗cd98hcecto抗体从患者来源的样品中免疫沉淀CD98hc(图2A),表明它识别未变性的CD98hc。为了进一步探讨这一点,我们将其转化为CRC细胞系,西方研究证实了CD98hc的表达(图2B)。使用抗cd98hcecto进行的细胞表面免疫沉淀实验表明,该抗体能够与细胞表面和天然CD98hc相互作用(图2C)。

结肠癌细胞中CD98hc抗体的内化。抗cd98hcecto与天然细胞表面CD98hc的相互作用。用抗cd98hcecto抗体免疫沉淀3例配对患者(正常和肿瘤)的组织提取物1 mg,用抗cd98hcv509抗体免疫印迹分析这些样品的免疫复合物和提取物。同样装载来自相同样品的细胞提取物(50µg)。Calnexin作为细胞提取样品的上样对照。CD98hc在结肠癌细胞系中的表达。裂解结肠癌细胞株,细胞提取物(20µg)用抗cd98hcv509抗体进行Western blot鉴定CD98hc。Calnexin作为上样对照。C CD98hc细胞表面免疫沉淀。分别用10 nM抗cd98hcecto在37℃条件下处理或不处理4株结直肠癌细胞系30 min。裂解细胞,用蛋白A-sepharose沉淀细胞提取物。免疫沉淀物中的CD98hc用抗cd98hcv509抗体进行Western blot分析。D免疫荧光法分析HT29细胞中抗cd98hcecto的内化情况。将细胞接种在盖片上,用10 nM的抗cd98hcecto处理30分钟、6小时、12小时和24小时。右侧的图像对应于24小时后图像中细胞的放大图。合并后的图像显示了CD98hc和LAPM1的共定位
我们通过免疫荧光研究来探索抗cd98hcecto抗体在结直肠癌细胞中的潜在内化动力学。为此,HT29或SW480细胞用饱和剂量(10 nM) CD98hcECTO抗体孵育不同时间。孵育30 min后,抗cd98hcecto抗体染色细胞表面(图2D和补充图2A)。孵育24小时后,除了膜染色外,还观察到细胞内抗体呈点状积聚。共定位研究表明,这种点状染色与溶酶体标记LAMP1一致。
抗cd98hc ADC在co中的抗增殖活性Lon癌细胞
由于上述数据证实CD98hcECTO抗体能够结合细胞表面CD98hc并内化到CRC细胞的溶酶体中,因此我们决定以其为骨架构建抗CD98hc ADC,以抗菌素管剂DM1为有效载荷。为了验证DM1与CD98hcECTO抗体的有效偶联,我们使用抗DM1抗体对未偶联抗体和偶联抗体进行了western blotting分析[14]。作为对照,我们使用市售曲妥珠单抗和曲妥珠单抗- dm1 (T-DM1)。虽然抗DM1抗体识别T-DM1和抗cd98hcecto -DM1中的偶联DM1,但它不能识别裸的、未偶联的曲妥珠单抗或抗cd98hcecto(补充图2B)。此外,在抗cd98hcecto的Ig重链中获得的信号强度与从市售T-DM1中获得的信号强度非常相似。这些实验表明,DM1有效地偶联到抗cd98hcecto抗体。此外,FACS分析表明,抗cd98hcecto - dm1抗体(此处称为抗CD98hc- dm1)保留了与完整的(i) HT29细胞(补充图2C), (ii)来自CRC患者生长的PDX细胞(补充图2D), (iii)来自CRC患者的肿瘤类器官分离的细胞(补充图2E)中存在的表面暴露的CD98hc相互作用的能力。
为了探讨抗cd98hc - dm1的抗增殖作用,我们用不同剂量的抗cd98hc - dm1 ADC治疗5株结直肠癌细胞系4天。这些研究显示,在研究的5种CRC细胞系中,MTT代谢呈剂量依赖性下降,MTT代谢被用作细胞数量的替代测量(图3A)。不同细胞系的IC50值相似,范围为3.16 ~ 4.06 nM。相比之下,用裸抗cd98hcecto抗体(以下简称抗cd98hc)处理并没有实质性地影响任何测试细胞系的增殖(图3B),这表明与抗体偶联的有效载荷是细胞增殖减少的主要原因。剂量反应研究还表明,HT29和HCT116细胞对抗cd98hc -DM1和自由载荷DM1的反应相似(图3C和D)。与图3B所示的数据一致,这些剂量反应实验也证实了裸抗体在任何浓度下都不影响HT29和HCT116细胞的增殖。

抗cd98hc ADC在结肠癌细胞系中的抗增殖活性。抗cd98hc - dm1在结直肠癌细胞系中的剂量反应分析。以指定剂量用ADC处理细胞4天。数据绘制为MTT代谢相对于对照的百分比。结果以重复两次实验的四次重复的平均值±标准差表示。右表为各细胞系抗cd98hc - dm1的IC50 (nM)。B裸抗cd98hc和抗cd98hc - dm1对结直肠癌细胞系增殖的影响。细胞用抗cd98hc或抗cd98hc - dm1 10 nM处理4天。数据绘制为MTT代谢相对于对照的百分比。结果以重复两次实验的三个重复的平均值±SD表示。C和D HT29 (C)和HCT116 (D)细胞分别用抗cd98hc、抗cd98hc -DM1或DM1剂量处理4天。数据绘制为MTT代谢相对于对照的百分比。结果以重复两次实验的三个重复的平均值±SD表示。用含有shRNA对照(sh-Control)或靶向CD98hc的shRNA序列(sh- cd98hc# 3和sh- cd98hc# 7)的慢病毒感染E HT29细胞。Western用抗cd98hcv509抗体验证了敲低效率。Calnexin作为上样对照。F利用CRISPR/Cas9基因敲除HT29细胞中的CD98hc。裂解亲本HT29细胞和CD98hc敲除的10个不同克隆,用抗cd98hcv509抗体Western blot分析CD98hc的表达水平。钙连蛋白和微管蛋白作为加载对照。G CD98hc敲低对抗CD98hc- dm1抗增殖作用的影响。用抗cd98hc - dm1 (1 nM和5 nM)处理HT29细胞4天。数据绘制为MTT代谢相对于对照的百分比。结果以重复两次实验的三个重复的平均值±SD表示。H抗CD98hc- dm1对亲本和CD98hc CRISPR #5和#11 HT29细胞增殖影响的剂量反应分析。结果以实验重复三次的四次重复的平均值±SD表示
为了探索抗CD98hc- dm1 ADC抗增殖作用的特异性,我们通过shRNAi降低CD98hc(图3E)。此外,利用CRISPR/Cas9技术生成了多个CD98hc-null的HT29细胞克隆(图3F)。在受对照shRNAi感染的亲本HT29细胞系中,ADC在1 nM和5 nM处均具有抗增殖作用,而CD98hc水平较低的HT29细胞对抗CD98hc- dm1的作用不太敏感(图3G)。在通过CRISPR/Cas9消除CD98hc表达的两个克隆(HT29 CD98hc CRISPR#5和#11)中分析抗CD98hc- dm1的抗增殖作用也得到了类似的结果(图3H)。值得注意的是,MTT代谢研究表明,HT29 CD98hc CRISPR#5的生长与亲本细胞相似(补充图3A)。
抗cd98hc - dm1 ADC在从正常结肠获得的非肿瘤人成纤维细胞以及永生化HaCaT角质形成细胞中的作用也进行了探索。后者表达的CD98hc水平与CRC细胞系相似,而人成纤维细胞表达的CD98hc要少得多(补充图3B)。如补充图3C所示,抗cd98hc - dm1 ADC对HaCaT具有与HT29细胞相似的抗增殖作用。相反,抗cd98hc - dm1 ADC对正常成纤维细胞的增殖作用非常微弱。
CD98hc-ADC在有丝分裂和有丝分裂突变中诱导细胞周期阻滞
分析了抗cd98hc - dm1 ADC在结直肠癌细胞系中抗增殖作用的机制。用ADC处理HT29或HCT116细胞的视觉检查显示,药物在处理24小时后使细胞变圆(图4A)。流式细胞术实验表明,抗cd98hc - dm1在G2/M细胞周期阶段引起细胞积聚,并在处理24(图4B)或48 h(补充图3D)时引起G0/G1的降低。Western blotting分析显示,ADC在处理1天后引起有丝分裂标记pHistone-H3和pBUBR1的积累(图4C)。细胞周期蛋白A和细胞周期蛋白B的表达也有所增加。此外,在这两种细胞系中,在S780处观察到Rb磷酸化增加,这与有丝分裂后期Rb的过度磷酸化状态一致(图4C)[47,48]。

抗cd98hc - dm1抗体在有丝分裂和有丝分裂突变中诱导细胞周期阻滞。抗cd98hc - dm1 (10 nM, 24 h)对HT29和HCT116单层细胞形态的影响B抗cd98hc - dm1 (10 nM, 24 h)对HT29和HCT116细胞株不同细胞周期(G0/G1、S和G2/M)分布的影响C .抗cd98hc - dm1对细胞周期进程相关蛋白表达和磷酸化水平的影响。用抗cd98hc - dm1 (10 nM)处理HT29和HCT116细胞,并在指定时间裂解。Western分析了所研究的不同蛋白的表达或磷酸化水平。以GAPDH作为加载对照。D抗cd98hc - dm1对主轴装配和组织的作用。HT29细胞接种于盖片上,用CD98hc-DM1 (10 nM)处理48h,固定并染色。绿色为β-微管蛋白,蓝色为DAPI。比例尺= 7.5µm。E 10 nM抗cd98hc - dm1处理72 h后HT29和HCT116细胞存活(Annexin v阴性/ pi阴性)和不存活的百分比。F抗cd98hc - dm1对不同凋亡相关蛋白水平的影响
免疫荧光实验显示,抗cd98hc - dm1 ADC在处理48 h时诱导异常有丝分裂纺锤体(图4D和补充图3E)。此外,我们在抗cd98hc - dm1处理72小时的HT29和HCT116细胞中观察到巨大的多核细胞(补充图3F)。这些异常的有丝分裂纺锤体的存在表明有丝分裂灾难,这是一种由有丝分裂进程缺陷引发的细胞死亡形式[49,50]。与此相一致的是,Annexin V/碘化丙啶染色显示,抗cd98hc - dm1 ADC在处理后72小时能够引起非活细胞的大量增加(图4E)。因此,用抗cd98hc - dm1处理HT29和HCT116细胞2-3天,会引起caspase 3和PARP的裂解形式增加(图4F)。DNA损伤标记物pH2AX水平的平行增加也被检测到。所有这些数据表明,用抗cd98hc - dm1 ADC治疗结肠癌细胞系可引起细胞周期阻滞并进展为细胞死亡。
CD98hc-DM1 ADC对正常和肿瘤患者源性类器官的作用
通过对患者源性类器官(PDOs)的功能研究,分析了使用抗CD98hc ADC靶向CD98hc在结直肠癌中的潜在相关性。这些研究不仅旨在检测抗cd98hc ADC对肿瘤组织的疗效,还旨在检测来自同一患者的正常结肠组织的PDOs的疗效。这些配对类器官的Western blotting研究显示,CD98hc在肿瘤PDOs中的表达高于正常结肠PDOs(图5A)。CA2,作为正常结肠组织的标记物[40],实际上只在正常结肠PDOs衍生的类器官中检测到。免疫荧光研究表明,肿瘤PDOs与抗cd98hcecto抗体孵育1.5小时,导致抗体在细胞表面积累(图5B)。这种染色在细胞的最外层观察到,在位于PDO内部的细胞中更难检测到。正如缺氧、营养和分化所预期的那样,在PDOs中央管腔内的细胞中观察到指示细胞凋亡的核碎片。

抗cd98hc - dm1对肿瘤患者源性类器官具有抗增殖作用。A CD98hc在正常和肿瘤PDOs中的表达水平。CD98hc和CA2(正常结肠标志物)的表达水平用抗cd98hcv509抗体进行Western blot分析。以GAPDH作为加载对照。B肿瘤PDOs中CD98hc的免疫荧光检测。用10 nM抗cd98hcecto抗体孵育肿瘤PDOs 1.5 h,免疫荧光法分析CD98hc的亚细胞分布。比例尺= 50µm。左边的图代表一个类器官,红色虚线表示拍摄图像的类器官区域。C评价抗cd98hc ADC对不同肿瘤PDOs细胞活力的影响。用10 nM抗cd98hc - dm1处理肿瘤PDOs 4天,按方法部分分析细胞活力。结果显示为重复两次实验的三个重复相对于未处理的类器官的倍数变化±SD。D抗cd98hc - dm1对配对正常和肿瘤PDO(#175)细胞活力影响的剂量反应分析,在4天进行分析。结果显示为重复两次实验的三个重复相对于未处理类器官的倍数变化±SD。P值采用Student t检验(双侧)计算。E免疫荧光分析抗cd98hc或抗cd98hc - dm1对肿瘤PDO的影响。用10 nM抗cd98hc或抗cd98hc - dm1处理类器官4天,免疫荧光法观察对细胞形态的影响。CD98hc染色为绿色,细胞核染色为蓝色。比例尺= 25µm。箭头表示核碎裂
为了探讨抗cd98hc - dm1 ADC的抗增殖作用,我们用10 nM的抗cd98hc - dm1 ADC处理3个肿瘤PDO培养4天。在所有病例中,使用抗cd98hc - dm1抗体治疗均降低了细胞活力(图5C)。发现抗cd98hc - dm1 ADC的作用是剂量依赖性的(图5D)。此外,当在配对的正常和肿瘤PDOs中探索抗cd98hc - dm1 ADC的作用时,在肿瘤样本中观察到更高的抑制作用(图5D)。免疫荧光实验显示,抗cd98hc - dm1 ADC引起细胞正常结构的改变和核断裂,具有凋亡细胞死亡的特征(图5E中箭头)。相比之下,裸抗cd98hc抗体处理并未引起PDOs细胞活力或形态学改变的任何实质性变化(图5E)。
CD98hc-DM1 ADC的体内抗肿瘤作用
接下来,我们在两种体内结肠癌模型中研究了抗cd98hc - dm1 ADC的作用,一种是来自裸鼠移植的HT29细胞,另一种是来自CRC患者移植的组织,建立了PDX。在第一种模型中,小鼠在背部右侧皮下注射HT29细胞,当肿瘤平均体积达到150 mm3时,每周随机接受载体(n = 6)或抗cd98hc - dm1 (n = 6)腹腔注射(共3次)。在体内模型中,使用抗cd98hc - dm1治疗可显著降低肿瘤生长(图6A),并有利于生存(补充图4A)。在整个实验过程中,实验组和对照组动物的体重没有明显变化(补充图4B)。相比之下,用裸抗cd98hc抗体或游离药物DM1治疗小鼠不影响肿瘤生长或存活(补充图4C和D)。

抗cd98hc - dm1 ADC对体内CRC模型具有抗肿瘤活性。抗cd98hc - dm1对HT29细胞移植裸鼠肿瘤生长的影响箭头表示抗cd98hc - dm1 (15mg /Kg)给药天数。数据以平均肿瘤体积±SEM绘制。P值采用Student 's t检验(双侧)计算。B抗CD98hc- dm1和CD98hc在小鼠肿瘤中的表达。开始治疗后第21天(末次治疗后第7天)取肿瘤标本。采用肿瘤组织提取物,分别用抗dm1抗体和抗cd98hcv509抗体进行Western blot分析抗CD98hc- dm1和CD98hc的表达水平。以GAPDH作为加载对照。C用抗cd98hcv509抗体对患者BT6224正常组织和肿瘤组织进行CD98hc免疫组化染色,用于生成PDX。BT6224衍生的PDX和HT29细胞中CD98hc表达的Western blot分析。Calnexin作为上样对照。E抗CD98hc-DM1对携带bt6224来源PDXs的裸鼠肿瘤生长的影响。箭头表示抗cd98hc - dm1 (15mg /Kg)给药天数。数据以平均肿瘤体积±SEM绘制。P值采用Student t检验(双侧)计算。F分别用抗dm1抗体和抗cd98hcv509抗体对肿瘤样品中抗CD98hc- dm1和CD98hc进行western blot评价。以GAPDH作为加载对照
在实验结束时(末次治疗后一周),将对照组或抗cd98hc - dm1治疗小鼠的肿瘤切除。抗dm1抗体的Western blotting显示,即使在最后一次治疗后一周,治疗小鼠的肿瘤中也积累了抗cd98hc - dm1(图6B和补充图4F)。这些西方研究也表明肿瘤表达CD98hc。其他西方研究表明,在抗cd98hc - dm1处理的小鼠中,pHistone-H3显著上调(补充图4E和F)。与体外研究相反,在抗cd98hc - dm1处理的样品中,未观察到caspase 3和PARP的切割。这可能是由于不同的实验设置。
对于第二个模型,小鼠通过皮下切口接种结肠癌患者的肿瘤块(BT6224)。该患者的正常和肿瘤手术样本的免疫染色显示,CD98hc在肿瘤中大量表达,而在正常绒毛中,CD98hc染色仅限于炎症基质成分(图6C)。该肿瘤在裸鼠体内增殖。对这些小鼠切除的肿瘤进行Western blotting分析显示,CD98hc的水平与体外培养的HT29细胞相似(图6D)。此外,来自这些pdx的组织的免疫组织化学分析显示,CD98hc在切除肿瘤的细胞膜上表达(补充图4G)。用抗cd98hc - dm1处理携带已建立的BT6224 pdx的小鼠,导致生长显著降低(图6E),并增强生存(补充图4H)。在用ADC治疗一周后,肿瘤大小的减小已经很明显,并且肿瘤大小的差异在实验期间保持不变。同样,与异种移植细胞系体内模型一样,治疗组和对照组动物的体重没有出现实质性变化或差异(补充图4I),并且肿瘤积累了抗cd98hc - dm1(图6F和补充图4J)。
下载原文档:https://link.springer.com/content/pdf/10.1186/s13046-023-02784-0.pdf







