摘要
发展和扩大食品中全氟烷基和多氟烷基物质(PFAS)的分析方法对于继续监测美国的食品供应和评估饮食接触情况至关重要。2022年3月,欧盟饲料和食品中卤化持久性有机污染物参考实验室(EURL POPs)发布了一份指导文件,涵盖了重点关注的PFAS,包括分析方法参数和定量限(loq)。因此,美国食品和药物管理局(FDA)开始了方法扩展工作,将10种新的分析物纳入方法C-010.02,包括长链全氟磺酸、氟端聚体磺酸盐和全氟辛烷磺酰胺。四种长链羧酸也在所有食品中得到验证,这些长链羧酸之前添加到C-010.02中,但只在海鲜中得到验证。2022年12月,欧盟公布了第2022/2388号委员会法规,规定了某些食品(主要是鱼类、软体动物、甲壳类动物和蛋类)中全氟辛烷磺酸(PFOS)、全氟辛酸(PFOA)、全氟壬酸(PFNA)和全氟己烷磺酸(PFHxS)的最大含量。因此,对FDA方法在达到委员会法规(EU) 2022/1431中定义的loq方面的性能进行了评估。发现FDA方法能够达到所有要求的定量限,用于确定最高水平的基质中的分析物。目前,被FDA用作监测样品中PFAS报告下限的方法检测限(mdl)与定义的指示性水平处于相同范围。通过进一步的方法改进,在水果、蔬菜和牛奶中可以达到要求的loq。要达到这些食物基质的较低目标loq,需要将方法转移到能够在定量下限提供更高信号噪声增益的仪器上。
图形抽象
介绍
全氟和多氟烷基物质(PFAS)是自20世纪50年代开始生产的含氟物质[1]。它们由不同链长的碳氟键组成,端基亲水,通常是羧酸或磺酸。多氟烷基物质具有一个或多个碳,其中氟取代了氢,从而使化合物通过羟基自由基取代氢原子以及随后的反应(如脱硫、羧化、CF2的损失)进行降解,形成稳定的最终产物[2]。由于这些化合物的高稳定性,它们已被用于室内装潢,食品接触物品,包装涂料,地毯和衣服作为防油和防水剂。此外,它们还被用于水性成膜泡沫(AFFF)中,近年来,这些泡沫的组成已从主要以全氟辛烷磺酸(PFOS)为基础转变为以氟端粒为基础的泡沫[3]。由于PFAS的持久性和生物积累和被植物和动物吸收的能力,PFAS已成为广泛存在的环境污染物。
通过受污染的水和食物的饮食暴露以及吸入室内空气可发生对人类的暴露[4]。为了监测食品供应中PFAS的污染,FDA开发了各种食品中PFAS的分析方法。最初,该方法包括16种分析物,并用于分析93个区域总饮食研究样本,包括乳制品、肉类、谷物和农产品[5]。随后对该方法进行了修订和扩展,用于150种加工食品[6]。最近,在对81个样品的海产品调查中,该方法被扩展到包括C11-C14中的另外4种长链羧酸盐,这些羧酸盐先前已被证明可以被海产品吸收[7]。该方法还扩展到青贮样品,并用于分析附近空军基地用AFFF污染的水和饲料饲养的奶牛饲喂的玉米青贮饲料[8]。
2022年,EURL POPs发布了一份用于确定食品中PFAS的分析方法的指导文件,概述了感兴趣的分析物,验证参数和分析方法性能标准。根据本文件的建议,C9-C13中的五种长链磺酸和全氟辛烷磺酰胺(FOSA)被添加到分析物清单中,以扩展方法。此外,由于四种氟端粒磺酸盐(FTSs)在AFFF中普遍存在,因此在分析方法中添加了四种氟端粒磺酸盐(FTSs),包括4:2,6:2,8:2和10:2。为了继续扩展用于其他分析物和基质的分析方法,使用先前在FDA开发的提取和仪器方法对7种食品和2种饲料基质上的30种PFAS进行了一次实验室验证[6,8]。
本研究的目的是对C-010.02方法进行分析物和基质扩展[9],以包括30种感兴趣的分析物和额外的食品和饲料样品,修改先前版本的方法以增强外部实验室的可转移性,并将FDA方法检测限(mdl)和定量限(loq)与EURL POPs设定的限值进行比较。
材料与方法
样品
用于矩阵扩展的样本包括与之前在总饮食研究中测试的样本相同的样本(生菜,牛奶,鲑鱼,面包)[5,6]。在本研究中,由于已知含巧克力食品中的全氟戊酸(PFPeA)会受到干扰,而鸡蛋中已知的胆酸会受到干扰,因此选择巧克力牛奶代替普通牛奶[6]。其他令人感兴趣的食物包括蛤,因为之前检测到PFOA浓度升高[10],以及蓝莓,这是一种高度色素化的食物。考虑到人们对动物饲料中PFAS的兴趣日益浓厚,以及在新墨西哥州青贮饲料样品中使用该方法[8],我们也对新墨西哥州和缅因州合作伙伴获得的青贮饲料和玉米进行了验证。
化学物质
分析标准品是从绝对标准公司(Hamden, CT)以定制混合的形式购买的。该混合物含有以下成分:全氟丁酸(PFBA);全氟戊酸;全氟己酸;全氟庚酸;全氟辛酸线性和支链混合物(br-PFOA);全氟壬烷酸;全氟癸酸;全氟癸酸;全氟十二烷酸;全氟三烷酸;全氟十四烷酸;全氟丁烷磺酸钾;全氟戊磺酸钠;线性和支链全氟己磺酸钠;全氟庚烷磺酸钠;全氟辛磺酸钾线性和支链混合物;全氟o2,3,3,3-四氟-2-(1,1,2,2,3,3,3-七氟proproxy)丙酸(HFPO-DA);十二氟- 3h -4,8-二氧嘧啶酸钠;9-氯十六氟-3-氧杂酮-1-磺酸钾(9Cl-PF3ONS);11-氯六氟-3-氧十二烷-1磺酸钾(11Cl-PF3OUdS)、全氟壬烷磺酸盐(PFNS)、全氟十烷磺酸盐(PFDS)、全氟十二烷磺酸盐(PFDoDS)、全氟三烷磺酸盐(PFTrDS)、全氟己烷磺酸(4:2 FTS)、全氟辛烷磺酸(6:2 FTS)、全氟十二烷磺酸(8:2 FTS)、全氟十二烷磺酸(10:2 FTS)、全氟辛烷磺酰胺(FOSA)。该标准混合物的浓度为2µg/mL,报告为阴离子浓度,因此不需要额外的盐校正。标记的替代标准品购自惠灵顿实验室;加拿大圭尔夫(M3PFBA, M3PFPeA, MPFHxA, M8PFOA, MPFUdA, MPFDoA, MPFTeDA, M3PFBS, MPFHxS, M8PFOS, M3HFPO, M8FOSA),以2 μ g/mL的定制混合物形式和剑桥同位素实验室;Tewksbury, MA (13C2d4 4:2 FTS 13C2d4 6:2 FTS, 13C2d4 8:2 FTS 13C2d4 10:2 FTS),自定义混合物,浓度为1µg/mL。使用仅标记为13C2的标准(如Wellington提供的)准确量化FTSs是具有挑战性的,因为校准曲线中天然FTSs中自然存在的M + 2同位素34S(4.25%)对替代区域有贡献[11]。因此,剑桥同位素被选择用于标记FTS分析物,因为他们提供除了13C2之外还有两个氘(d4)的标记标准物。注射前添加的内标n -乙基-d5-全氟-1-辛烷-溶剂酰胺乙酸(d5N-EtFOSAA)购自惠灵顿。
对于该方法的扩展,将以前方法[5,6]中使用的PFOS和PFOA技术标准替换为来自Absolute standards (Hamden, CT)的合成分支PFOS和PFOA标准。虽然在研究实验室中普遍使用全氟辛烷磺酸技术标准,但在将该方法扩展到具有一定纯度要求的其他实验室时,该标准的纯度存在问题。因此,从绝对标准中选择纯度为99%的PFOS和PFOA的合成支化标准,因为它们与NIST RM 8447和NIST RM 8446中线性和支化异构体的比例最接近。在绝对支化全氟辛烷磺酸标准中,基于面积的线性与支化异构体的比例为68%线性和32%支化,与NIST RM 8447中64%线性和36%支化的比例最为一致。所有溶剂(甲醇、水和乙腈)均为LC-MS Optima级(Fisher Scientific, Waltham, MA),流动相添加剂(乙酸铵和1-甲基哌啶;1-MP)和用于固相萃取(SPE)洗脱溶剂的氢氧化铵也从Fisher Scientific (Waltham, MA)购买。
QuEChERS提取
提取协议与前面描述的相同[6,8,10]。所有食品样品均使用IKA管磨机(IKA Works, Inc., Wilmington, NC)均质。饲料样品使用Robot-Coupe (Ridgeland, MS)和干冰研磨成粉末。简单地说,将5 g均质食物或1 g均质饲料加入50 mL离心管中。饲料样品需要较小的样本量,因为共萃取会导致5克样品的色谱迅速恶化。较低的样本量允许更有效地清理基质。加水膨胀基质(大多数样品为5 mL,干样/饲料样品为15 mL),以10 mL乙腈作为提取溶剂,加入150µL甲酸。然后在每个样品中加入盐包,用手摇动或旋转,直到盐均匀且未观察到结块(6000 mg MgSO4和1500 mg NaCl) (ECMSSFCS-MP, UCT, Bristol, PA)。样品在1500 rpm下振荡和旋转5分钟,脉冲为70 (Glas-Col, Terre Haute, IN),并在10,000 rcf下离心5分钟。将上清转移到dSPE管(900 mg MgSO4, 300 mg PSA和150 mg CGB (ECMPSCB15CT, UCT, Bristol, PA)。然后用与之前相同的条件摇动/旋转和离心该管。然后,用0.2µm尼龙过滤器过滤5ml的dSPE提取物,并保留1ml的等分液用于SPE净化。对于干/饲料样品,将5ml的dSPE萃取物浓缩至1ml。在QuEChERS提取的肉类和农产品中,人们早就知道,伯仲胺(PSA)和石墨化炭黑(GCB)的组合在去除共萃取的基质成分方面具有优势[12]。虽然在dSPE步骤中由于PSA的存在有可能造成分析物的额外损失,但我们发现这种损失是微不足道的[5]。当去除PSA,只使用GCB时,提取物在视觉上要深得多,特别是对于着色食品和青贮样品。
SPE清理
SPE清理与前面描述的一样[6,10]。简单地说,1 mL过滤后的乙腈dSPE萃取物用水稀释到12 mL。Strata XL-AW (200 mg, 6 mL, 100µm, Phenomenex, Torrance, CA)滤筒用6 mL洗脱溶剂(0.3% w/w的氢氧化铵在甲醇中)洗涤,并用5 mL水平衡。装上样品,用5毫升水清洗墨盒。然后用4ml 0.3% w/w的氢氧化铵在甲醇中洗脱墨盒。将样品浓缩至约1ml,分析前加入内标d5N-EtFOSAA。在分析过程中,运行牛磺酸去氧胆酸(TDCA)、牛磺酸去氧胆酸(TCDCA)和牛磺酸去氧胆酸(TUDCA)的分析标准品,监测其在样品提取物中的存在。已知牛磺酸脱氧胆酸的这些异构体会干扰鸡蛋、牛奶、肝脏、肉类和海鲜等食物中全氟辛烷磺酸的499→80 MRM过渡。在此方法中,只有TCDCA与PFOS有色谱干扰。如果同时检测到PFOS和TCDCA(499→124),则执行额外的SPE清理步骤。简单地说,250mg / 6ml的ENVI-Carb墨盒(SupelClean, ENVI-Carb, Millipore Sigma, St. Louis, MO)加入4ml的甲醇,然后3ml的QuEChERS萃取物通过墨盒。然后将洗脱液吹至接近干燥,在加入内标准品之前用3ml甲醇重组。萃取物仅用于分析全氟辛烷磺酸。
LC-MS /MS仪器分析
将Nexera X2 (Shimadzu, Kyoto, Japan)液相色谱系统与带有电喷雾离子源(ABSciex, Toronto, ON Canada)的Sciex 6500 + QTRAP混合三重四极杆/线性离子阱质谱联用。分析物采用XBridge BEH C18分析柱(130 Å, 3.5µm, 2.1 × 150 mm)分离,ACQUITY BEH C18 VanGuard预柱(130 Å, 1.7µm, 2.1 × 5mm)作为保护柱(Waters, Milford, MA), XBridge BEH C18柱(130 Å, 3.5µm, 2.1 × 50 mm)作为延迟柱。流动相由5毫米乙酸铵和5毫米1-MP在水(A)和甲醇(B)中组成,梯度和其他仪器条件先前已报道。[6]在流动相中使用1-MP观察到的改进包括减少背景和增强负模式下的电离,这导致平均比不使用1-MP低2倍的方法检测限。
LC-HRMS仪器分析
由于基质干扰和PFBA和PFPeA的假阳性可能性(因为它们只有一次MS/MS转换),使用液相色谱/高分辨率质谱(LC-HRMS)通过精确的质量来确认这些分析物的存在和浓度。LC- hrms仪器包括一个Nexera超高性能LC(日本京都岛津)和一个Q-Exactive Orbitrap质谱仪(Thermo Fisher Scientific, Waltham, MA)。LC分离使用与LC - MS/MS分析相同的条件进行[5],只是由于两种仪器之间的空隙体积差异,在方法结束时将平衡保持时间增加到10% B的5分钟。质谱仪采用负离子极性,全扫描(100-1200 m/z)方法,分辨率为70 k, AGC靶为1e6,最大进样时间为250 ms。调整加热电喷雾电离(HESI)源参数,以最大限度地减少PFBA和PFPeA的源内碎片,使用鞘气流量35 au,辅助气体流量10 au,喷雾电压- 2.5 kV,毛细管温度350℃,S-lens RF水平25,辅助气体加热器温度310℃。对PFBA (m/z 212.9792)和PFPeA (m/z 262.9760)的精确质量生成萃取离子色谱图,质量精度公差为±5 ppm,并使用峰强度值进行定量。浓度的计算遵循与LC-MS /MS数据相同的同位素稀释程序。
目录
摘要 介绍 材料与方法 结果 讨论 参考文献 作者信息 道德声明 相关的内容 搜索 导航 #####结果
方法扩展和验证
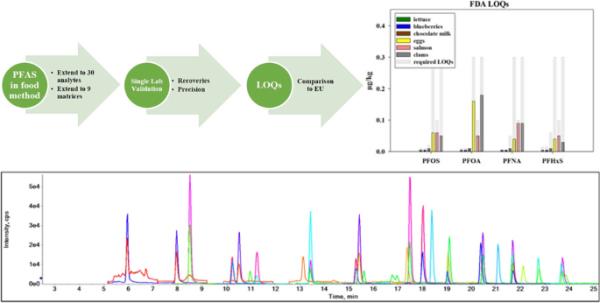
对于分析物和基质扩展,选择了七种食物基质来覆盖过去验证中分析的样品(生菜、牛奶(巧克力)、鲑鱼、面包)[5,6]、高优先级食物(蛤蜊)和已知干扰的基质(鸡蛋、巧克力牛奶)[6]。对于饲料样品,选择青贮饲料和玉米是因为它们具有干扰和基质效应的挑战性饲料基质。每种食品以4种不同浓度(0.15µg/kg、1µg/kg、5µg/kg和15µg/kg)加标3份,方法检出限为0.05µg/kg。所有峰值用于验证28种分析物的LC-MS /MS方法,三个最高峰值用于验证PFBA和PFPeA的LC-HRMS方法。对于1 ppb的方法水平,要求回收率在40-120%范围内,对于10 ppb的方法水平,要求回收率在60-115%范围内,并且% rsd≤22%[13]。在图1中,通过结合每种食物类型在四种浓度(0.15µg/kg, 1µg/kg, 5µg/kg, 15µg/kg)下的三个峰值的百分比回收率创建箱形图。对于先前已验证的16种PFAS分析物,所有回收率均在可接受范围内。在过去的验证中,11cl - pf3oud在面包中的回收率低于40%[5,6]。MPFHxS是目前用于定量11cl - pf3oud的替代标准品。如果使用MPFDoA(保留时间最接近的代理)而不是MPFHxS,则所有恢复都通过验证。该替代物并非所有食品基质中11Cl-PF3OUdS的最佳替代物,因此仅在面包中11Cl-PF3OUdS的方法中进行了调整。对于在此扩展中测试的14种新分析物,当使用M8PFOS作为这些分析物的替代标准时,一些长链全氟磺酸(PFSAs)最初在面包(PFDS, PFUdS, pfdo, PFTrDS),鸡蛋(pfdo, PFTrDS),巧克力牛奶,鲑鱼和蛤蜊(PFTrDS)中未达到所需的最低40%回收率。mpfda用于PFUdS, MPFDoA用于pfdo, MPFTeDA用于PFTrDS时,回收率有所提高。对于新的代物,一些回收率仍然没有通过验证,因为它们在鸡蛋中PFTrDS超过120%,而在鲑鱼和蛤蜊中PFTrDS的峰值很低。面包中PFDS、PFUdS和pfdo的一些峰值回收率仍低于40%。在玉米和青贮中也观察到同样的改善,除了pfdo和PFTrDS(以M8PFOS为替代标准)的回收率都在可接受范围内,但当MPFDoA和MPFTeDA作为匹配的替代标准时,回收率就通过了。在面包和青贮饲料等复杂食品中,适当匹配的替代标准更为重要,这种分析将受益于额外的长链标记pfsa的商业可用性,以实现最准确的定量。对于PFBA和PFPeA,在所有基质的HR-MS仪器上运行1、5和15µg/kg峰值进行验证。该仪器用于基于精确质量(±5 ppm)验证PFBA或PFPeA的阳性检测,所有回收率均在可接受范围内,且% rsd≤22%,符合指导文件的要求[13](图1)。

来自LC-MS /MS分析的12个总峰的箱形图,在以下浓度(0.15µg/kg, 1µg/kg, 5µg/kg和15µg/kg)下各有3个峰。左边是原始16个分析物的箱形图,右边是额外的14个分析物。红线表示添加1µg/kg样品所需的回收率范围为40-120%
与EURL POP loq的比较
2022年8月,欧盟发布了委员会建议(EU) 2022/1431,要求在2022年至2025年期间监测成员国食品中PFAS的存在。然后,在2022年12月的委员会法规(EU) 2022/2388中,欧洲食品安全局(EFSA)确定了特定食品中四种PFAS的最大摄入量(PFOS, PFOA, PFNA, PFHxS)[14]。在已确定最高水平的食物组(鱼肉、蛋类、甲壳类、软体动物)中,给出了全氟辛烷磺酸、全氟辛酸、全氟辛酸和全氟辛酸的限定限[15,16]。对于尚未确定最高水平的食品(牛奶、水果、蔬菜、真菌和婴儿食品),为监测目的,EURL POPs文件[16]给出了目标限量和所需限量。在欧盟2022/1431中,EURL POPs文件中列出的要求loq被定义为指示性水平,两份文件中对这些食品的目标loq相同[15,16]。EURL POPs文件中用于计算loq的方法定义为满足以下参数的最低成功验证浓度:离子比±30%,信噪比S:N≥3,精度≤20%,符合性样品的真度在- 20%到+ 20%之间[16]。
对于在验证中测试的食品(鲑鱼,蛤蜊,鸡蛋),目前欧盟2022/2388规定的最大水平,四种PFAS分析物(PFOS, PFOA, PFNA, PFHxS)的loq都低于EURL POPs规定的loq(表1)。当查看EURL POPs规定的用于监测目的的验证食品(蓝莓,生菜,牛奶)的loq时,使用FDA方法计算的loq高于规定的loq,除了牛奶中的PFNA和PFHxS。为了与欧盟要求的定量限进行更准确的比较,我们进行了3次5、10和20 ng/kg的峰值测量,以确定使用FDA方法成功验证的最低水平。在20 ng/kg条件下,牛奶、生菜和蓝莓的回收率均达到80-120%,RSD≤20%。为了调整方法以降低这些基质的定量限,对农产品和牛奶样品增加了一个额外的浓缩步骤。在dSPE步骤后,将5ml(而不是1ml)提取物浓缩至1ml并用于SPE分析,最终提取物减少至0.5 mL而不是1ml。这一额外步骤使蓝莓和生菜的loq超过了5ng /kg的验证水平,牛奶的loq超过了10ng /kg的验证水平。除了在欧盟2022/1431中也被描述为指示性水平的监测目的所需的loq外,EURL POPs也对无最高限量的食品描述了较低的目标loq。目前,为了使用FDA方法达到这些较低的目标loq,需要对分析仪器进行调整。
MDLs
FDA目前使用40 CFR 136附录B中定义的mdl作为可用于膳食暴露评估筛选的最低报告浓度。MDL等于低水平加标矩阵(0.05µg/kg)的样本标准差乘以n-1自由度的第99百分位单尾t统计量的相应学生t值[14,17]。这导致最小浓度明显不同于零,并因不同的分析物和基质而异。为了确定定量限,将样本标准差乘以10。
人们认识到MDL和LOQ代表不同的概念,MDL定义可检测的值,LOQ定义可量化的值。由于FDA目前正在报告所有高于最高限量的数据,生菜、蓝莓和牛奶的最高限量也与监测目的所需的最低限量进行了比较,以比较欧洲和美国监测食品供应时报告的浓度差异。当比较蓝莓的FDA MDL和EURL LOQ时,PFOA和PFHxS低于要求的0.015µg/kg, PFOS为0.015µg/kg,而要求的0.010µg/kg。对于生菜,PFHxS低于要求,PFOS和PFOA均为0.014µg/kg,而要求为0.010µg/kg。PFNA含量更高(0.014µg/kg和0.013µg/kg,而所需含量为0.005µg/kg)。对于MDL牛奶的比较,4种分析物中有3种低于EURL POPs要求的loq, PFOA为0.020 μ g/g,而要求的0.010 μ g/kg。
讨论
FDA对食品中PFAS的分析方法从16种分析物扩展到30种分析物,允许对可能在美国食品供应中发现的其他分析物进行测定。这种扩展的方法将允许在未来的总饮食研究样本中确定这些分析物,这些样本用于评估饮食暴露,以及其他涉及受环境污染影响的食物的研究。FDA的方法可以量化低于建议loq的优先食品中委员会法规(EU) 2022/2388中确定的最高水平的分析物。出于监测目的,FDA报告高于mdl的值,这些值与EURL POPs对监测样品要求的loq相当。这表明在美国和欧洲报告的值高于类似的阈值,但在FDA方法中需要额外的浓缩步骤才能达到农产品和牛奶所需的loq。对于暴露评估,需要尽可能低的loq,并且需要不断改进仪器和方法以达到EURL POPs的目标loq。通过不断扩大和改进食品中PFAS的分析方法,FDA可以提高其对PFAS饮食暴露的了解和对美国市场食品中PFAS的监测。
下载原文档:https://link.springer.com/content/pdf/10.1007/s00216-023-04833-1.pdf







